|
1) TEORIA
ELETTROCHIMICA DELLA CORROSIONE
La prima applicazione
della protezione catodica risale al 1824, molto prima che il
relativo fondamento teorico venisse formulato.
La protezione
catodica e' probabilmente diventata il metodo piu' usato per
impedire il deterioramento da corrosione delle strutture metalliche
in contatto con qualsiasi forma di ambiente elettroliticamente
conduttivo, ambienti cioe' che contengano abbastanza ioni per
condurre elettricita' (come il terreno, l'acqua di mare ed
essenzialmente tutte le acque naturali).
La protezione
catodica riduce in pratica il tasso di corrosione di una struttura
metallica riducendo il relativo potenziale di corrosione, portando
cioe' il metallo piu' vicino ad un stato inerte.
La corrosione si
verifica quando un materiale si deteriora a causa della propria
reazione con l'ambiente. Per esempio, una tubazione d'acciaio
sotterranea reagisce con l'ossigeno dissolto presente nel terreno. A
livello elettrochimico, la corrosione metallica e' una reazione
di tipo "redox" per la quale il metallo viene ossidato
mentre l'ossigeno presente nell?ambiente diminuisce.
Un metallo in
contatto con un ambiente conduttivo come l'acqua o la terra e' il
centro delle reazioni elettrochimiche denominate "effetto
batteria". Questo fenomeno ha un effetto di dissoluzione sul
metallo dall'anodo al catodo, in altre parole dal tubo verso la zona
circostante.
Affinche' la
corrosione si verifichi devono essere presenti quattro elementi:
elettrolito, anodo, catodo e un circuito di ritorno. Un metallo si
corrodera' nel punto in cui la corrente si separa dall'anodo.
Nell'immagine sotto, la corrosione e' causata da due diversi tipi di
suolo, che danno luogo a una differenza di potenziale.
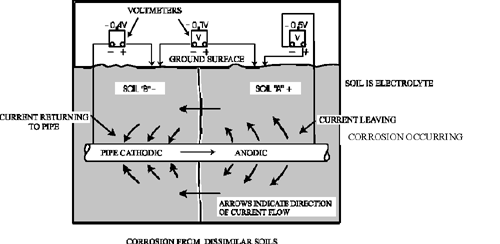
La
reazione anodica (di ossidazione) provoca la dissoluzione del metallo
(in questo caso ferro) come:
Fe -> Fe2+ + 2e-
Il pH
influenza la reazione di ossidazione. Una tubazione d'acciaio
sotterranea catodicamente protetta, forma un ambiente alcalino e
cos', la reazione catodica e' una riduzione dell'ossigeno ad
alto pH.
O2 + 2H2O + 4e- -> 4OH-
Sia la reazione di
ossidazione che la reazione di riduzione devono verificarsi alla
stessa velocita' sulla superficie della tubazione. La reazione
generale puo' essere ottenuta aggiungendo le reazioni di riduzione e
di ossidazione:
2Fe + 2H2O + O2 -> 2Fe2+ + 4OH-
Questa
reazione da' luogo a quel composto chimico ferroso che viene
comunemente chiamato ruggine.
Per sviluppare la
corrosione, gli elementi visti in precedenza danno luogo ai seguenti
fenomeni:
-
La corrente passa attraverso l'elettrolito dall'anodo al catodo.
Essa ritorna all'anodo tramite il circuito di ritorno.
La corrosione si
verifica ogni volta che la corrente si separa dal metallo (tubo,
struttura, ecc.) ed entra in contatto col terreno (elettrolito). La
zona dove la corrente si separa e' chiamata anodica. La
corrosione, quindi, si presenta nella zona anodica.
La corrente
rientra poi al catodo e in questa zona infatti non c'e' fenomeno di
corrosione. Attorno al catodo si riscontra il fenomeno della
polarizzazione (formazione di un film di idrogeno) che riduce il
flusso di corrente di corrosione.
Il flusso di
corrente e' causato da una differenza potenziale (di tensione) fra
l'anodo ed il catodo. Il livello catodico di protezione e' il
valore potenziale sotto il quale l'acciaio non si puo' corrodere. Per
acciaio posto sotto terra o immerso, il livello di protezione viene
misurato con un elettrodo di riferimento di tipo Cu/CuSO4 a diretto
contatto con il metallo. Tale livello e' di norma -850 mV.
2) TIPI DI
PROTEZIONE CATODICA
Ci sono
essenzialmente due metodi di protezione catodica: il sistema ad
anodi galvanici (sacrificali) ed il sistema a corrente
impressa. L'idea di base e' fornire elettroni alla struttura
metallica (tubazione sotterranea o altro) per impedire la
dissoluzione del metallo.
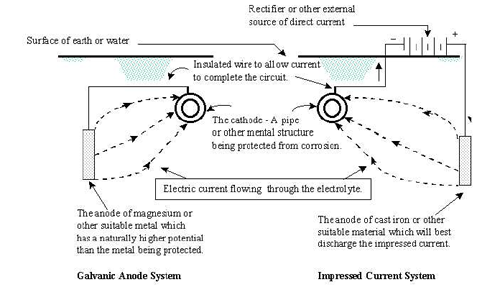
Qualsiasi corrente
intesa come flusso di elettroni, che si separa dalla tubatura, sia
essa corrente galvanica o diffusa, causa corrosione.
Generalmente, il
controllo della corrosione si ottiene come segue:
a) Sistema
ad anodi galvanici (o sacrificali)
Nei sistemi ad anodi
galvanici, la struttura metallica (sotterranea) da proteggere e'
collegata ad un metallo meno nobile quali zinco o magnesio. Una volta
collegati, formano una coppia galvanica. L'anodo sacrificale si
corrodere' ad una velocita' superiore di quella con cui si
corroderebbe da solo, mentre la struttura metallica agiraa' da catodo
e si corroderaa' ad una velocita' inferiore di quella con cui si
corroderebbe da sola.
Gli anodi
Sacrificali sono cosi' chiamati perche' il materiale viene consumato
per proteggere struttura e in ultimo devono essere sostituiti.
Gli anodi vengono
dimensionati in base alla resistivita' dell'ambiente (terreno.) Gli
anodi sono fatti di materiali quali il magnesio (Mg), zinco (Zn) o
alluminio (Al). Sono solitamente installati nelle immediate vicinanze
della parte da proteggere e sono collegati ad essa con un conduttore
isolato.
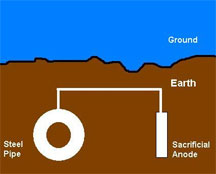
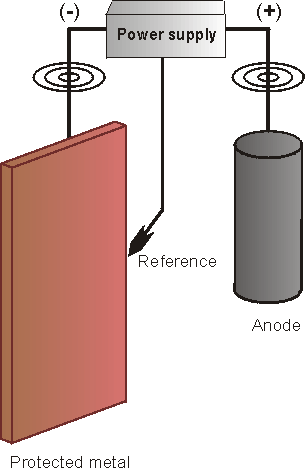
b) Sistemi a
corrente impressa
In alternativa al sistema ad
anodi sacrificali, una struttura metallica puo' anche essere protetta
a mezzo di un sistema che sfrutta una alimentazione esterna.
Il terminale negativo
di un raddrizzatore di corrente e' collegato al componente da
proteggere, mentre il terminale positivo ad un materiale inerte
(anodo). In tal modo viene impresso un flusso di corrente fra la
parte da proteggere e l'anodo e la corrosione viene fermata.
Gli anodi
sono collegati ad una fonte di corrente DC, quale ad esempio un
raddrizzatore o un generatore. Questi sistemi sono usati normalmente
lungo le tubazioni di trasmissione in cui vi sono meno probabilita'
di interferenza con altre tubazioni. Il principio e' lo stesso
visto in precedenza salvo che gli anodi sono fatti di materiale
resistente alla corrosione quali la grafite, il ferro siliconato ad
alta lega, leghe di piombo-argento o platino.
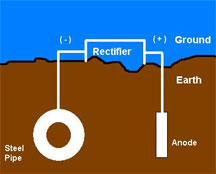
La
corrente da imprimere al sistema per garantirne la protezione contro
la corrosione varia considerevolmente a seconda della
superficie e volume da proteggere, del terreno e di altri fattori, da
50 milliampere fino a 120 ampere. Come valori tipici di riferimento,
per proteggere una testa pozzo viene applicata una corrente nella
gamma di 2 - 6 ampere, mentre per sistemi di tubazioni sono
solitamente nella gamma di 8 - 30 ampere.
Dove la fornitura di
energia elettrica e' disponibile facilmente, viene solitamente usato
un raddrizzatore da AC a DC . Nelle zone isolate la corrente DC puo'
essere fornita comunemente da un sistema di generazione di corrente a
pannelli fotovoltaici (vedi
http://www.ori.milano.it/tss4u_sistemi_solari_fotovoltaici.php)
3) GLOSSARIO
Corrosione
- il deterioramento di una struttura metallica o tubazione
etc. La corrosione e' causata da una reazione fra la parte
metallica e l'ambiente che la circonda. Anche se la corrosione non
puo' essere eliminata totalmente, essa puo' essere ridotta i maniera
sostanziale con la protezione catodica.

Esempio di tubo
d'acciaio installato per servizio del gas. Notare le profonde cavita'
di corrosione che si sono formate.
Protezione
catodica - una procedura grazie la quale una struttura
metallica viene protetta dalla corrosione. Consta in un flusso
continuo di elettroni impresso sulla struttura per mezzo di un anodo
sacrificale o di un raddrizzatore.
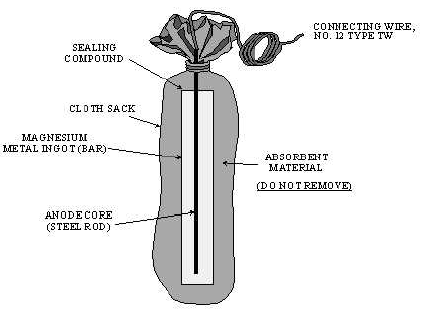
Anodo
(sacrificale) - un insieme che consiste in un sacchetto che
contiene solitamente un lingotto di zinco o di magnesio ed altri
prodotti chimici. Esso e' collegato tramite un cavo isolato ad
un sistema metallico da proteggere (es.: sotterraneo). Funziona come
batteria che imprime una corrente continua sul sistema di tubazione
per ritardare la corrosione.
Protezione
Sacrificale - la riduzione della corrosione di un metallo
(solitamente acciaio) in un elettrolito (terreno) tramite
accoppiamento galvanico del metallo (acciaio) ad un metallo pi?
anodico (magnesio o zinco.)
Elettrodo
di riferimento (comunemente denominato half-cell) - un
dispositivo che solitamente ha del rame immerso in una
soluzione di solfato di rame. Il suo potenziale rimane costante sotto
circostanze simili di misurazione.

4)
MISURE E CONTROLLI,REQUISITI DI INSTALLAZIONE E MANUTENZIONE
a) Punti
di misurazione
Lo scopo della
misurazione e' controllare il potenziale della parte da proteggere in
relazione all'ambiente circostante. Il numero delle misurazioni da
effettuare dipende dal layout dell'impianto, dalle differenze nel
suolo e dalle apparecchiature da proteggere.
b)
Misura del potenziale
E' essenziale
misurare il potenziale delle apparecchiature da proteggere, in modo
da controllare l'efficienza della protezione catodica. Il potenziale
viene misurato con l'uso di elettrodi di riferimento.
Gli elettrodi
utilizzati sono:
Elettrodi di calomelano (laboratorio)
Elettrodi di
solfato di rame Cu/CuSO4 (comunemente usati)
Elettrodi di
cloruro d'argento Ag/AgC1 (acqua di mare)
Elettrodi di
zinco (acqua di mare).
c) Requisiti di
installazione e manutenzione
Un tester appropriato per la protezione catodica deve verificare il
sistema entro sei mesi dopo l'installazione e da li in poi ogni tre
anni.
Dovrebbe essere
sempre verificata la presenza di un potenziale negativo di -850
millivolt o di -0.85 volt fra il sistema da proteggere e un
elettrodo di riferimento a contatto con il terreno nelle sue
immediate vicinanze
Devono essere di
norma conservati i risultati degli ultimi due controlli .
E' buona norma
controllare l'efficacia di un sistema a corrente impressa ogni 60
giorni per accertarsi che il sistema stia funzionando correttamente.
Deve essere
conservato un resoconto degli ultimi tre controlli .
5)
NORME DI RIFERIMENTO:
EN 12954 :
protezione catodica delle strutture metalliche sotterranee o immerse:
tubi.
EN 12068 : copertura integrale esterna per
proteggere dalla corrosione dei tubi d'acciaio sotterranei o immersi
relativi alla protezione catodica - strisce e materiali ritrattabili.
EN 12495 : protezione catodica delle strutture
d'acciaio fissate in mare.
EN 12473 : principi
generali di protezione catodica in mare.
EN 12696 :
protezione catodica di acciaio fissato nel calcestruzzo.
|